


|
Propriété de Mandet Christophe |


|
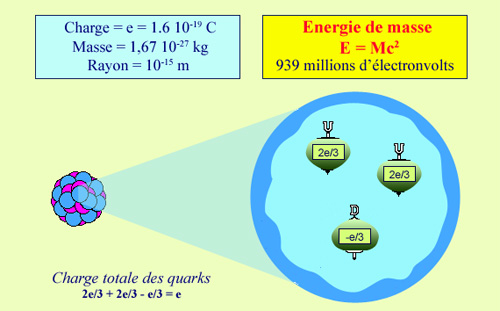
Proton |
|
Structure du proton
|
|
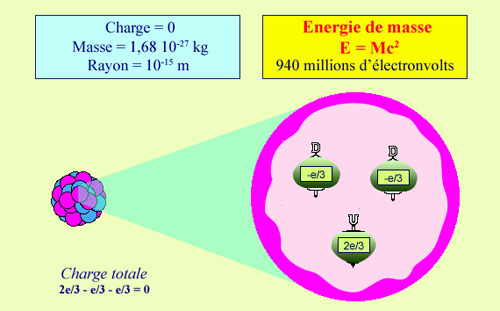
Neutron |
|
Structure du neutron |

|
Isotopes |
|
Les trois isotopes de l'hydrogène |
|
Uniquement présents dans le noyau et dépourvus de charge électrique, les neutrons jouent un rôle négligeable pour ce qui concerne le reste de l'atome, en particulier les propriétés chimiques. Les physiciens appellent « isotopes » ces variantes jumelles d'un atome, dont le noyau diffère seulement par le nombre de neutrons. |
|
Source infos laradioactivite.com |
Etats d'énergie du noyau
Des analogies avec l'atome |
|
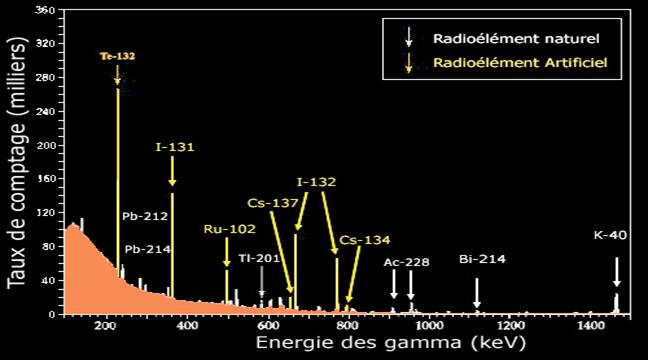
Spectre gamma |
|
Les noyaux sont a priori très différents des atomes. Cent mille fois plus petits, ils sont plus complexes. La matière nucléaire est compacte alors que l'espace atomique est essentiellement constitué de vide. Pourtant noyaux et atomes présentent des traits communs. |

|
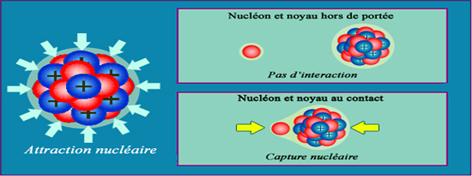
Une colle nucléaire ... |
|
Ils tiennent ensemble sous l'effet d'une interaction de contact, appelée « nucléaire » ou forte, car il s'agit de la force dominante. Bien qu'extrêmement intense, l'interaction nucléaire est restée longtemps insoupçonnée, parce qu'elle est à très courte portée. Elle le serait encore, sans la découverte en 1896 de la radioactivité. Cette courte portée se manifeste par le fait que des neutrons peuvent passer au voisinage immédiat d'un noyau sans être captés. |
|
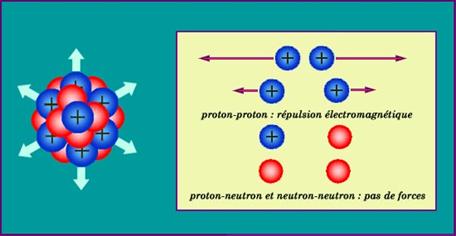
Des forces de répulsion électromagnétiques s'exercent dans le noyau entre charges électriques de même signe. Ces charges sont portées par les protons. Les protons étant pratiquement au contact, il faut que les forces nucléaires attractives soient très intenses pour vaincre la répulsion de ces charges confinées dans une minuscule sphère dont le rayon est de quelques millionièmes de milliardième de mètre. |
|
La répulsion électrique des protons |
|
Le noyau de l'atome d'hydrogène se réduit à une particule unique, porteuse d'une charge électrique positive : le proton. La valeur de cette charge (appelée e) est 1,6 dix milliardième de milliardième de Coulomb, l'unité standard de charge électrique. Cette charge si infime est considérée comme élémentaire, car on ne connaît pas de corpuscules (hormis les quarks) possédant des charges plus petites et toutes les charges observées dans les atomes et les molécules en sont un multiple entier, positif ou négatif. |
|
Un parallèle entre charge électrique et charge « forte ». |
|
A très courte distance, au contact les uns des autres, les neutrons et les protons sont soumis de manière équivalente aux forces qui agglomèrent les nucléons pour former les noyaux. Les deux espèces de nucléons jouent un rôle semblable à l'intérieur desc noyaux. Mais les neutrons, électriquement neutres, ne subissent pas la répulsion d'origine électrique que subissent les protons du fait de leur charge éleectrique. Du fait de cette répulsion qui croit avec le nombre de protons, on observe un excédent de neutrons de plus en plus accentué quand les noyaux deviennent gros. |
|
L'agent des réactions nucléaires |
|
Spectre gamma du cobalt-60 |
|
|
|
Les états excités du Nickel-60 sont atteints lors de la désintégration bêta d’un élément radioactif très utilisé en médecine, le cobalt-60. Lors du retour à l’état fondamental, divers gamma sont émis, selon le chemin choisi par le noyau pour atteindre le repos. Certains sont plus fréquents que d’autres. Dans cet exemple, on observe dans pratiquement 100 % des retours deux gamma émis en cascade d’énergie voisine de 1 MeV . Les autres gamma jouent un rôle marginal. Ces deux gamma d’énergies caractéristiques (1.17324 et 1.33250 MeV) offrent une signature extraordinairement sensible de la désintégration du cobalt radioactif. |
|
IN2P3 |
|
Quand le noyau se trouve dans un autre état, il dispose d'un supplément d'énergie. Il retourne à l'état normal (celui de repos maximum) et se débarrasse de son énergie d'excitation en émettant un photon d'énergie caractéristique, appelé photon γ ou gamma. Ces photons sont de même nature que les photons et rayons X émis par les atomes, mais leur énergie est beaucoup plus grande : couramment de l'ordre du million d'électronvolts (MeV). |
|
En plus de cette structure en couches, le noyau peut avoir des mouvements collectifs qui correspondent à de nouveaux états. Ainsi la communauté de nucléons peut entrer en vibration. Les énergies de ces vibrations ne peuvent prendre que des valeurs bien déterminées, en vertu de la mécanique quantique. |
|
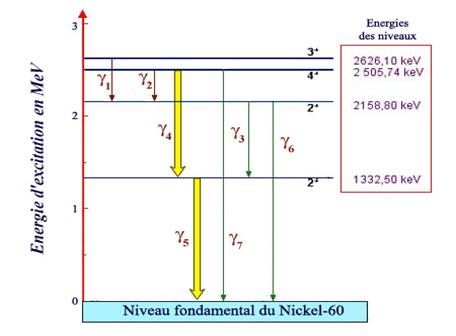
Niveaux d'énergie du Nickel-60 |
|
|
|
Ce diagramme représente l’échelle des énergies d’excitation permises pour un noyau de nickel-60, résultat de la désintégration du cobalt-60. Le niveau le plus bas, appelé niveau fondamental, correspond au repos. Quand le noyau est dans un des niveaux excités (l’un des barreaux de l’échelle), il retourne immédiatement au niveau fondamental en émettant un ou plusieurs gamma d’énergies caractéristiques. Ces énergies sont obtenues en faisant la différence des énergies de départ et d’arrivée, définies très précisément. Les transitions en cascade numérotées 4 et 5 , 1000 fois plus fréquentes que les autres ont été représentées par des flèches épaisses. |
|
IN2P3 |
Forces NucléairesTrois forces en action dans le noyau et leur hiérarchie |
|
(Les forces faibles) |
|
Deux charges électriques de même signe se repoussent. Cette répulsion varie en raison inverse de la distance selon la loi de Coulomb. Les protons (en bleu) sont soumis à cette répulsion dans le noyau, contrairement aux neutrons (en rouge) dépourvus de charge électrique qui ne subissent pas la « répulsion coulombienne ». Sans les forces nucléaires qui maîtrisent la répulsion des protons, le noyau exploserait. Il faut que ces forces soient très intenses pour arriver à confiner les protons dans un volume aussi petit que le noyau. |
|
|
|
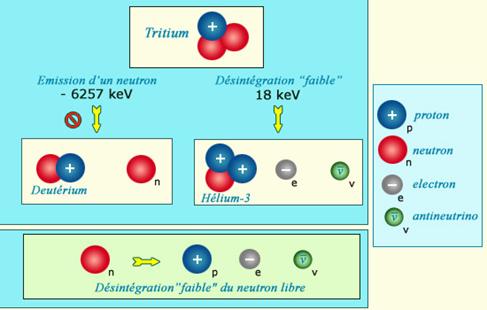
L'exemple du tritium, le plus simple des noyaux radioactifs, montre comment la nature à recours à transformation d'un neutron en proton, due aux « forces faibles » pour modifier le rapport entre lesdeux espèces de nucléons. Le tritium, pourrait expulser un de ses deux neutrons mais cette expulsion ne se produit pas spontanément car elle coûte de l'énergie. Par contre, la désintégration d'un neutron en proton accompagné d'un électron bêta et d'un antineutrino, libère un peu d'énergie Cela suffit pour que le tritium soit radioactif. C'est la force faible qui rend le tritium instable. |
|
|
|
La troisième force présente dans le noyau est une force discrète. Elle joue pourtant un rôle fondamental dans l'univers. Sans la « force faible », le soleil s'arrêterait de briller parce qu'il ne pourrait pas fusionner l'hydrogène en deutérium. En rendant possible, si le bilan énergétique le permet, de transformer un proton en neutron ou inversement, la force faible dépeuple les coteaux de la vallée de stabilité et rassemble tous les noyaux au fond de la vallée. |
|
Sans l'intervention des forces faibles, nous aurions bien davantage que 287 nucléides « naturels » dans notre environnement. L'expulsion d’un proton ou neutron coûte de l'énergie et faute de pouvoir transformer l'un dans l'autre plusieurs milliers de noyaux radioactifs deviendraient stables. |